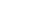研究経緯
当研究室のモイメンリン教授が、国立感染症研究所時代に、倉根一郎元所長、髙崎智彦元室長の教えをもとに、アルボウイルス(節足動物媒介性ウイルス)感染症のデング熱、ジカ熱、チクングニア熱等研究や、関連するワクチン研究に着手しました。また、モイ教授は在職中に、中和抗体の機能等を解析するための「抗体依存性感染増強(ADE)試験法」を独自に開発しました。現在も国立健康危機管理研究機構(国立感染症研究所)、長崎大学熱帯医学研究所、ベトナム、マレーシアなどの主要な研究機関で、ワクチン開発などに活用されており、日本国内にとどまらず、グローバルな舞台で新たな貢献を果たしました。
長崎大学熱帯医学研究所時代には、それまでの研究を独自性をもって発展させ、その結果、日本ウイルス学会・杉浦奨励賞(デングウイルスに対するワクチン・治療法の開発のための評価系構築とそれを用いた発症メカニズムの解析)や、日本医療研究開発機構(AMED)・理事長賞(デング熱やジカ熱などの蚊媒介性感染症の伝播様式及び免疫応答の解明への貢献)等を受賞して、日本で公に認められる研究成果となりました。
これらの実績が認められて、2021年、東京大学大学院医学系研究科 国際保健学専攻 国際生物医科学講座・発達医科学へ転籍し研究を継続。
2022年には、日本国政府主導のワクチン研究組織、日本医療研究開発機構(AMED) 先進的研究開発戦略センター(以下、SCARDA)が設置され、「ワクチン開発のための世界トップレベル研究開発拠点の形成事業」としてスタートしました。
国立大学法人 東京大学では、SCARDA組織による世界トップレベル研究開発のフラグシップ拠点『東京大学国際高等研究所 新世代感染症センター』を設置。
ウイルス研究で名高い河岡義裕機構長のもと、モイ教授はデング熱、ジカ熱等に関するワクチンの主任研究員(教授兼任)として研究をおこなっています。
以上のことから、デング熱、ジカ熱、日本脳炎、チクングニア熱等の病因、予防、治療法などの研究、関連するワクチン研究では、名実ともに先進的なノウハウを有している研究室となっております。
研究テーマ
新興・再興感染症のサーベイランス調査
デング熱やジカ熱の流行地域では、大規模な蚊の繁殖地があり、ウイルスの侵入および局所的な伝播は大規模な流行につながる可能性があるため、蚊媒介性感染症の伝播様式の把握とその解析結果に基づく対策提言の推進は重要です。本教室では、タイ、マレーシア、フィリピン、インドネシア、ベトナム、ネパールなどアジア諸国と蚊媒介性ウイルス感染症などのフィル―ド調査を行い、流行地におけるウイルス感染症伝搬様式の解明、感染予防に貢献すべくさらなる研究を進めています。主な関連論文:
- Sano Y, Al-Alawi H, Himeno M et al Assessment of flavivirus RNA stability and infectivity in various water environmentsTrop Med Health 2025;53(1):11.
- Prajapati S, Elong Ngono A, Mc Cauley M et al. Genomic sequencing and neutralizing serological profiles during acute dengue infection: A 2017 cohort study in Nepal.PLOS Glob Public Health. 2024;4(11):e0002966
- Rahmasari R, Raekiansyah M, Aliyah SH. et al Development and validation of cost-effective SYBR Green-based RT-qPCR and its evaluation in a sample pooling strategy for detecting SARS-CoV-2 infection in the Indonesian setting. Sci Rep. 2024;14(1):1817
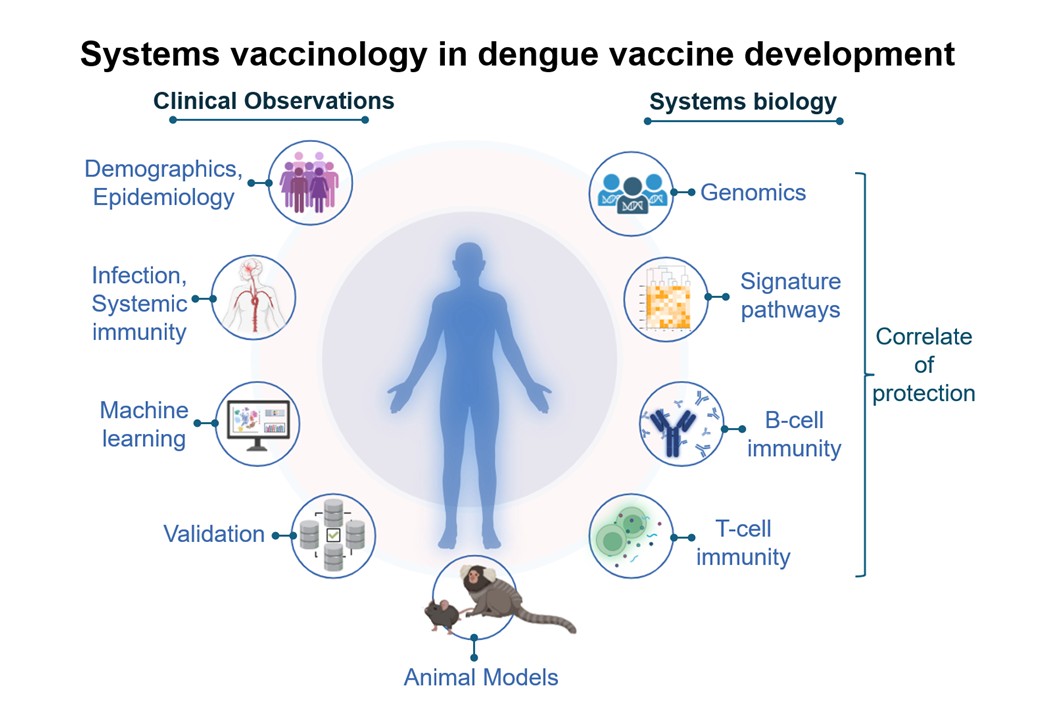
ウイルス感染とホスト免疫応答に関する研究
デングウイルス感染では、感染によって誘導された宿主免疫は感染防御に働くと同時に、感染増強を誘導して重症化につながることが知られています。 当教室では、デングウイルスやジカウイルスなどの蚊媒介性ウイルスの感染症の再感染時に誘導される感染増強抗体活性の解析を行い、デング熱患者の免疫応答や重症化機構の一端を解明しきました。この成果はワクチンと治療薬開発の基盤確立にも貢献しています。現在は、感染による抗体免疫応答の解析に加え、抗体誘導のレベルと相関するT細胞エピトープを同定し、感染増強活性のメカニズムの解明、及び、有効なワクチン開発に貢献することを目指しています。主な関連論文:
- Haga K, Chen ZN, Himeno M, et al. Utility of an In-Vitro Micro-Neutralizing Test in Comparison to a Plaque Reduction Neutralization Test for Dengue Virus, Japanese Encephalitis Virus, and Zika Virus Serology and Drug Screening. Pathogens. 2023;13(1):8.
- Nakamura Y, Moi ML, Shiina T, Shin-I T, Suzuki R. Idiotope-Driven T-Cell/B-Cell Collaboration-Based T-Cell Epitope Prediction Using B-Cell Receptor Repertoire Sequences in Infectious Diseases. Viruses. 2023;15(5):1186.
- Nguyen TTN, Choo EM, Nakamura Y, et al. Pre-existing cross-reactive neutralizing activity against SARS-CoV-2 and seasonal coronaviruses prior to the COVID-19 pandemic (2014-2019) with limited immunity against recent emerging SARS-CoV-2 variants, Vietnam. Int J Infect Dis. 2024;139:109-117.
- Muraoka D, Moi ML, Muto O, et al. Low-frequency CD8+ T cells induced by SIGN-R1+ macrophage-targeted vaccine confer SARS-CoV-2 clearance in mice. NPJ Vaccines. 2024 ;18;9(1):173..
- Thoresen D, Matsuda K, Urakami A, et al. A tetravalent dengue virus-like particle vaccine induces high levels of neutralizing antibodies and reduces dengue replication in non-human primates. J Virol. 2024;98(5):e0023924.
- Taniguchi S, Maruyama J, Saito T, et al. Development of reverse genetics system for Guanarito virus: substitution of E1497K in the L protein of Guanarito virus S-26764 strain changes plaque phenotype and growth kinetics.J Virol. 2024;98(2):e0196423
- Ana-Sosa-Batiz F, Verma SK, Shafee N, Miller R, et al. A humanised ACE2, TMPRSS2, and FCGRT mouse model reveals the protective efficacy of anti-receptor binding domain antibodies elicited by SARS-CoV-2 hybrid immunity. EBioMedicine. 2025;113:105619.
- フラビウイルスの迅速診断系の開発・評価
- 新興・再興感染症の抗原予測システム構築・感染における免疫応答の解析
- ウイルス感染・防御に関わるウイルス・ホスト因子の解析
- フラビウイルス感染症ワクチン・治療薬の開発・評価
- ワクチン・治療薬の開発に資するモデル生物の開発
- フラビウイルス重症化における抗体依存性感染増強(ADE)メカニズム解明
- 感染症のフィールド調査、疫学解析
- 母子感染症と神経発達症の発症メカニズム解明
- 母子保健、疾病対策の強化に資する調査研究
- 卒論テーマ配属のご案内はこちらのページへ
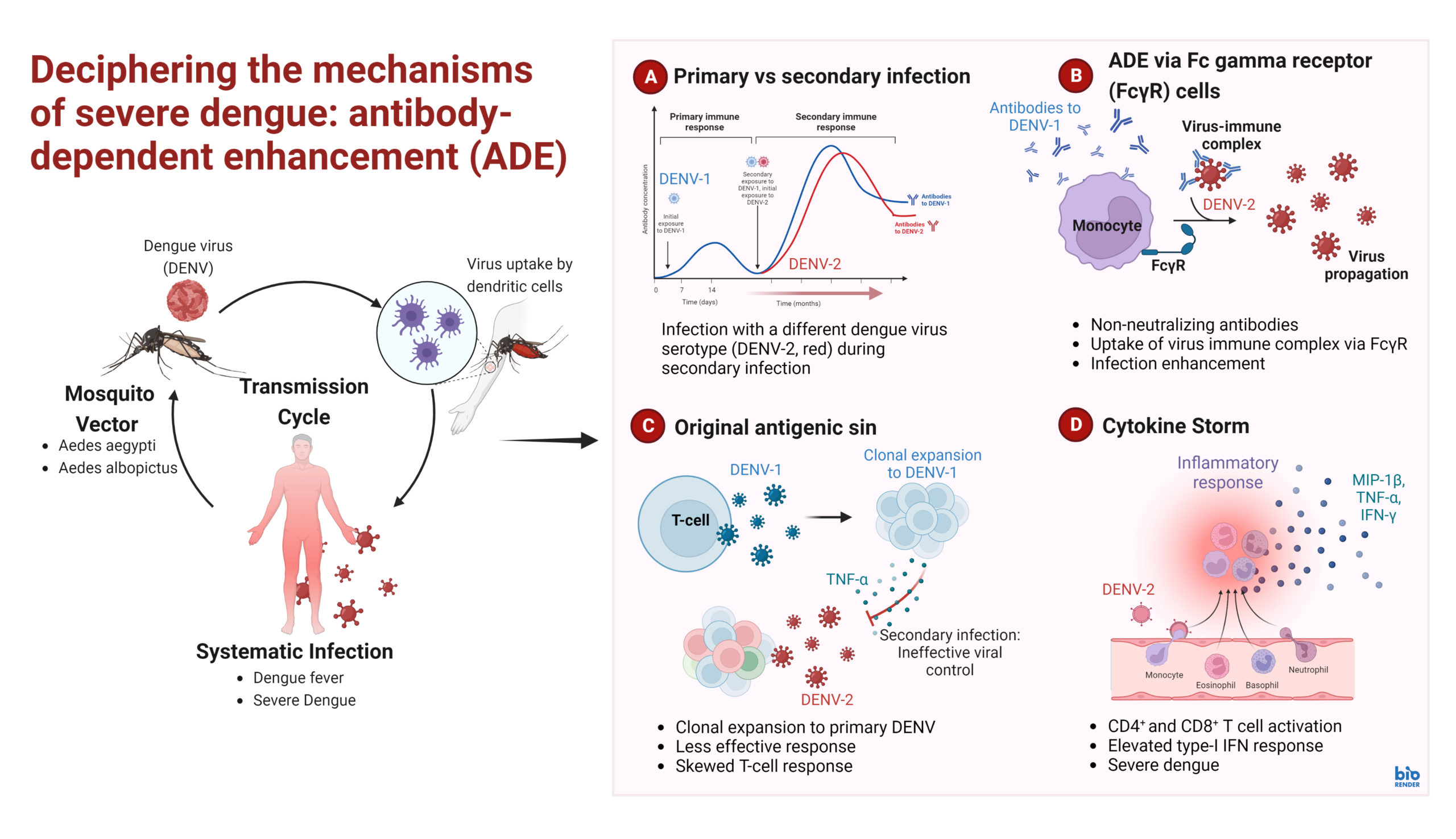
節足介性ウイルス感染症の診断薬、ワクチン・治療薬 の開発
節足介性ウイルス感染症は、デング熱、ジカ熱、チクングニア熱などに代表され、熱帯・亜熱帯地域で毎年流行を繰り返し、多くの死者を出しています。しかし、現在でもこれらの疾患に対する特異的な治療法はなく、対症療法が主体となっています。当教室では、日本脳炎、デング熱、ジカ熱、チクングニア熱などの診断法開発・評価、およびワクチン・治療薬の評価に用いるモデル生物の開発研究を進めています。デングウイルス(DENV)には4つの血清型が存在し、ワクチン開発においては、すべての血清型に対して防御免疫を確立することが重要です。DENVに感染すると、ウイルスに対する中和抗体が産生され、それによってウイルスの発症が防御されます。しかし、DENV感染で誘導された交叉抗体は、①中和、②感染増強(ADE)という二つの相反する活性を持っています。中和活性が優位な場合は、感染防御が成立すると考えられています。
一方、感染増強活性が優位な場合は、抗体依存性感染増強(Antibody-dependent enhancement, ADE)を介した重症化リスクが高まります。したがって、すべての4血清型に対し中和活性を示す防御免疫の誘導が、デング熱のワクチン開発において重要な課題です。デング熱ワクチンでは、ウイルスの血清型・株を超えて感染を防御できる質の高い中和抗体である「広域中和抗体」が産生されることが重要です。デングウイルスの2回目以降の感染では、すべての血清型を中和する広域中和抗体が誘導されるため、2回目以降の感染はほとんど起こりません。一方、防御免疫においては、ヘルパーT細胞の活性化がB細胞の機能を助けることが知られています。
モイ教授らの研究グループはこれまで、患者やモデル生物を用いて、デング熱などの節足動物媒介性ウイルスの感染における抗体のADE活性解析およびADE発症メカニズムを研究してきました。また、デング熱の感染においては細胞性免疫の誘導が不可欠であることから、当研究グループは新規のエピトープ予測技術を開発し、デング熱回復患者の先行研究から効率よくT細胞を誘導できるT細胞エピトープを見出しています。そこで、ウイルス抗原タンパク質の天然状態を安定化させる技術を確立し、T細胞エピトープと組み合わせたワクチンデザインを導入することで、抗原性をさらに改良するための研究を行っています。これらの両方の技術はデング熱ワクチンの実現化においてきわめて重要であり、国内・世界的に見ても例がないことから、優位性と独自性を持つデング熱、ジカ熱などのフラビウイルスワクチンを実現させることを目標としています。
主な関連論文: